Клатратные соединения инертных газов. Соединения инертных газов Соединения благородных газов
Благородные газы имеют электронную конфигурацию ns 2 np 6 (у гелия 1s 2) и составляют VIIIA подгруппу. По мере возрастания порядкового номера, растут радиусы атомов и их поляризуемость. Это приводит к усилению межмолекулярных взаимодействий, к повышению температур плавления и кипения, к увеличению растворимости газов в воде и других растворителях. Для благородных газов известны следующие группы соединений: молекулярные ионы, соединения включения и валентные соединения.
Молекула благородного газа Э 2 существовать не может – (s) 2 (s*) 2 . Но если удалить один электрон, то заполнение верхней разрыхляющей орбитали лишь наполовину – (s) 2 (s*) 1 является энергетической основой существования молекулярных ионов благородных газов Э 2 + .
Соединения включения, или клатраты , известны только в твердом состоянии. В ряду Не – Rn устойчивость клатратов возрастает. Например, гидраты типа Э. 6Н 2 О образуются при высоких давлениях и низких температурах. При 0 0 С гидраты Xe, Kr, Ar и Ne устойчивы при давлениях соответственно ~1,1 . 10 5 , 1,5 . 10 6 , 1,5 . 10 7 , 3 . 10 7 Па. Клатратные соединения используют для разделения и хранения благородных газов. Kr и Хе получают при ректификации жидкого воздуха.
Соединения с валентными связями Э(II), Э(IV), Э(VI), Э(VIII) хорошо изучены на примере фторидов Kr и Хе, полученных по схеме:
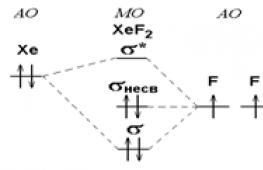
Химическая связь в соединениях благородных газов не может быть описана с позиций МВС, поскольку в соответствии с этим методом в образовании связи должны участвовать d - орбитали. Однако возбуждение атома Хе от состояния 5s 2 5p 6 в 5s 2 5p 5 6s 1 или 5s 2 5p 5 5d 1 требует 795 или 963 кДж. моль –1 , а возбуждение 5s 2 5p 4 5d 2 и 5s 2 5p 4 5d 1 6s 1 ‑ 1758 и 1926 кДж·моль –1 , что не компенсируется энергией образования связи.
В рамках ММО строение ХеF 2 объясняется схемой из трех орбиталей – одной от Хе и двух от атомов фтора:

Тетрафторид ксенона – сильный окислитель:
Pt + XeF 4 + 2HF = H 2 + Xe,
4KI + XeF 4 = Xe + 2I 2 + 4KF.
При нагревании и гидролизе фториды ксенона диспропорционируют:
2ХеF 2 = XeF 4 + Xe
3ХеF 4 = 2XeF 6 + Xe
6XeF 4 + 12H 2 O = 2XeO 3 + 4Xe + 3O 2 + 24HF.
Для шестивалентного Хе известны фторид ХеF 6 , оксид ХеО 3 , оксофториды ХеОF 4 и ХеО 2 F 2 , гидроксид Xe(OH) 6 , а также комплексные ионы типа ХеО 4 2– и ХеО 6 6– .
ХеО 3 хорошо растворим в воде и образует сильную кислоту:
ХеО 3 + Н 2 О⇆ Н 2 ХеО 4 ® Н + + НХеО 4 ¯ .
Гексафторид очень активен, реагирует с кварцем:
2ХеF 6 + SiO 2 = 2XeOF 4 + SiF 4 .
Производные Хе(VI) – сильные окислители, например:
Хе(ОН) 6 + 6KI + 6HCl = Xe + 3I 2 + 6KCl + 6H 2 O.
Для Хе(VIII) известны, кроме того, ХеF 8 , XeO 4 , XeOF 6 , XeO 6 4– .
В обычных условиях ХеО 4 медленно разлагается:
3ХеО 4 = Хе + 2ХеО 3 + 3О 2 .
По мере увеличения степени окисления ксенона устойчивость бинарных и солеподобных соединений падает, а анионных комплексов – возрастает.
Для криптона получены лишь KrF 2 , KrF 4 , неустойчивая криптоновая кислота KrO 3 · H 2 O и ее соль ВаKrO 4 .
Гелий используется в низкотемпературных процессах для создания инертной атмосферы в лабораторных аппаратах, при сварке и в газозаполненных электрических лампах, неон – в газоразрядных трубках.
Соединения благородных газов используются в качестве сильных окислителей. В виде фторидов ксенона хранят фтор и ксенон.
Вопросы для самопроверки
I. 1) Место водорода в периодической системе.
2) Классификация соединений водорода.
II. 1) s - Элементы: степени окисления, изменение радиусов и энергий ионизации, кислотно-основные и восстановительные свойства соединений.
2) Соединения s - элементов:
а) гидриды s- элементов (природа связи, свойства);
б) соединения с кислородом; гидроксиды.
III. 1) Что определяет валентные возможности р -элементов?
2) Как изменяется устойчивость высших и низших степеней окисления в подгруппах с ростом Z?
IV. Анализируя изменение Т пл. оксидов, ответьте на следующие вопросы:
1) Почему при переходе от СО 2 к SiO 2 резко повышается температура плавления?
2) Почему PbO 2 термически менее стабилен, чем другие оксиды IVA подгруппы?
V. Энергия связи в молекулах водорода и галогенов характеризуется следующими величинами:
1) Чем объясняется значительно большая энергия связи в Н 2 ?
2) Почему энергия связи в Г 2 сначала увеличивается с ростом Z, а затем уменьшается?
VI. Как и почему изменяются кислотно-основные свойства бескислородных (Н n Э) и кислородсодержащих Э(ОН) n , Н n ЭО m соединений р - элементов в периоде и группе?
VII. Водородные соединения р - элементов:
1) Связь, периодичность свойств, устойчивость.
2) Склонность к образованию Н-связи.
3) Особенность химической связи в В 2 Н 6 (ММО).
VIII. Оксиды р - элементов. Связь и свойства.
IX. Соединения р - элементов – полупроводники.
1) Факторы, определяющие ширину запрещенной зоны.
2) Элементарные полупроводники и соединения с полупроводниковыми свойствами. Их место в периодической системе.
Х. Алмазоподобные соединения. Положение элементов, их образующих, в периодической системе. Связь и свойства.
ХI. 1) Cоединения благородных газов и способы их получения.
2) Приведите схему МО для ХеF 2.
3) Напишите уравнения реакции диспропорционирования ХеF 2 , XeF 4 .
Экспериментальная часть
Царегородцев Александр
Соединения благородных газов - одна из интереснейших тем в органической и неорганической химии, открытие свойств их соединений перевернуло с ног на голову представление всех ученых 20 века, потому что в то время существование таких веществ считалось невозможным, а сейчас это воспринимается как нечто нормальное, то, чему уже найдено объяснение.
Ксенон - благородный газ, которому проще всех образовывать связи с другими химическими веществами. Человечество обуздало его соединения, и они применяются в нашей жизни уже сейчас.
Представленная работа может вызвать интерес широкой публики к указанной теме.
Скачать:
Предварительный просмотр:
Муниципальное автономное общеобразовательное учреждение
«Средняя школа № 5 с углубленным изучением химии и биологии»
Учебная исследовательская работа в рамках
V Менделеевских чтений
Тема: Соединения благородных газов
Выполнил: Царегородцев
Александр, ученик 9в класса
Руководитель: Григорьева
Наталья Геннадьевна, учитель химии
Старая Русса
2017
Введение
Инертные газы - неметаллы, находящиеся в VIII-a группе. Они были открыты в конце 19 века и считались лишними в Периодической системе, однако благородные газы заняли свое место в ней.
Из-за заполненного последнего энергетического уровня долгое время считалось, что эти вещества не могут образовывать связи, т.к. и после открытия их молекулярных соединений многие ученые были в шоке и не могли этому поверить, потому что это не поддавалось законам химии, существовавшим в то время.
Неудачные попытки образования соединений благородных газов неблагоприятно сказывались на энтузиазме ученых, однако это не помешало развиваться данной отрасли.
Я попытаюсь вызвать интерес у присутствующих в аудитории, перед которыми я представляю свою работу.
Цель моей работы : изучить историю создания и свойства неорганических соединений ксенона.
Задачи :
1. Ознакомиться с историей получения соединений благородных газов
2. Ознакомиться со свойствами фтористых и кислородных соединений
3. Донести результаты моей работы до учеников
Историческая справка
Ксенон был открыт в 1898 году, и сразу же через несколько лет были получены его гидраты, а также ксенона и криптона, которые все назывались клатратами.
В 1916 году Кессель, основываясь на значениях степеней ионизации инертных газов, предсказал образование их прямых химических соединений.
Большинство ученых 1 четверти 20 века считали, что благородные газы находятся в нулевой группе Периодической системы и имеют валентность 0, но в 1924 году А. фон Антропов вопреки мнениям остальных химиков отнес данные элементы к восьмой группе, из чего следовало, что высшая валентность в их соединениях - 8. Также он предсказал то, что они должны образовывать связи с галогенами, то есть неметаллами VII-a группы.
В 1933 году Полинг предсказал формулы возможные соединений криптона и ксенона: устойчивые гексафторид криптона и ксенона (KrF
6
и XeF
6
), неустойчивый октафторид ксенона (XeF
8
) и кислоту ксенона (H
4
XeO
6
). В этом же году Г.Оддо попытался синтезировать ксенон и фтор путем пропускания электрического тока, но не смог отчистить получившееся вещество от продуктов коррозии сосуда, в котором проводилась эта реакция. С этого момента у ученых пропал интерес к данной теме, и вплоть до 60-х годов этим почти никто не занимался.
Прямым доказательством того, что соединения благородных газов возможны, стало синтезирование британским ученым Нилом Бартлеттом гексафторплатината диоксигенила (O
2
). Гексафторид платины обладает окислительной способностью вдове большей, чем у фтора. 23 марта 1962 года Нил Бартлетт провел синтез ксенона и гексафторида платины, и он получил то, что желал: первое существующее соединение благородных газов - твердое вещество желтого цвета Xe. После этого все силы ученых того времени были брошены на создание фтористых соединений ксенона.
Фтористые соединения ксенона и их свойства
Первым молекулярным соединением являлся гексафторидплатинат ксенона с формулой XePtF 6 . Это твердое вещество, снаружи желтого цвета, а внутри кирпично-красного; при нагревании 115°С становится стеклообразным на вид, при нагревании в 165°С начинает разлагаться с выделением XeF 4 .
Также его можно получить при взаимодействии ксенона и пероксида фтора:
И также при взаимодействии ксенона и фторида кислорода под высокой температурой и давлением:
XeF2 это бесцветные кристаллы, растворимые в воде. В растворе он проявляет очень сильные окислительные свойства, однако они не превышают способности фтора. Самое прочное соединение.
1.При взаимодействии со щелочами ксенон восстанавливается:
2.Можно восстановить ксенон из этого фторида при взаимодействии с водородом:
3.При возгонке дифторида ксенона получается тетрафторид ксенона и сам ксенон:
Фторид ксенона (IV) XeF4 был получен также, как как и дифторид, но при температуре в 400°C:
XeF 4 – это кристаллы белого цвета, является сильным окислителем. О свойствах этого вещества можно сказать следующее.
1. Является сильным фторирующим агентом, то есть при взаимодействии с другими веществами способен передавать им молекулы фтора:
2.При взаимодействии с водой тетрафторид ксенона образует оксид ксенона (III):
3.Восстанавливается до ксенона при взаимодействии с водородом:
Фторид ксенона (VI) XeF 6 образуется при еще большей температуре и при повышенном давлении:
XeF 6 это бледно-зеленоватые кристаллы, также имеющие сильные окислительные свойства.
1. Как и фторид ксенона (IV) является фторирующим агентом:
2. При гидролизе образует ксеноновую кислоту
Кислородные соединения ксенона и их свойства
Оксид ксенона (III) XeO
3
- это белое, нелетучее, взрывчатое вещество, хорошо растворимое в воде. Оно получается при гидролизе фторида ксенона (IV):
1.При действии озона на щелочной раствор образует соль ксеноновой кислоты, в которой ксенон имеет степень окисления +8:
2.При взаимодействии соли ксенона с концентрированной серной кислотой образуется оксид ксенона (IV):
ХеО 4 - при температуре ниже -36°С кристаллы желтого цвета, при температуре выше - бесцветный взрывоопасный газ, разлагающийся при температуре 0°С:
В итоге у нас выходит, что фториды ксенона - это белые либо бесцветные кристаллы, растворяющиеся в воде, обладающие сильными окислительными свойствами и химической активностью, а оксиды легко высвобождают тепловую энергию и следствием этого является их взрывоопасность.
Применение и потенциал
Из-за своих свойств соединения ксенона могут быть использованы:
- Для производства ракетного топлива
- Для производства лекарственных препаратов и медицинского оборудования
- Для производства взрывчатки
- Как сильные окислители в органической и неорганической химии
- Как способ транспортировки химически активного фтора
Заключение
Соединения благородных газов - одна из интереснейших тем в органической и неорганической химии, открытие свойств их соединений перевернуло с ног на голову представление всех ученых 20 века, потому что в то время существование таких веществ считалось невозможным, а сейчас это воспринимается как нечто нормальное, то, чему уже найдено объяснение.
Ксенон - благородный газ, которому проще всех образовывать связи с другими химическими веществами. Человечество обуздало его соединения, и они применяются в нашей жизни уже сейчас.
Я считаю, что полностью достиг цели своего исследования: как можно точнее раскрыл тему, содержание работы полностью соответствует его теме, изучена история создания и свойств неорганических соединений ксенона.
Список литературы
1. Кузьменко Н.Е «Краткий курс химии. Пособие для поступающих в вузы» //Издательство Высшая школа, 2002, стр. 267
2. Пушлёнков М.Ф «Соединения благородных газов»//Атомиздат, 1965
3. Фримантл М. «Химия в действии» Часть 2//издательство Мир, 1998, стр. 290-291
4. Интернет ресурсы
http://him.1september.ru/article.php?ID=200701901
http://rudocs.exdat.com/docs/index-160337.html
https://ru.wikipedia.org/wiki/Фторид_ксенона(II)
https://ru.wikipedia.org/wiki/Фторид_ксенона(IV)
https://ru.wikipedia.org/wiki/Фторид_ксенона(VI)
http://edu.sernam.ru/book_act_chem2.php?id=96
http://chemistry.ru/course/content/chapter8/section/paragraph2/subparagraph7.html#.WLMQ5FPyjGg
Предварительный просмотр:
Чтобы пользоваться предварительным просмотром презентаций создайте себе аккаунт (учетную запись) Google и войдите в него: https://accounts.google.com
Подписи к слайдам:
Фтористые и кислородные соединения благородных газов. Соединения ксенона Выполнил: Царегородцев Александр, ученик 9 в класса МАОУ СОШ№5 Руководитель: Григорьева Наталья Геннадьевна, учитель химии
Введение Инертные газы - неметаллы, находящиеся в VIII - a группе. Они были открыты в конце 19 века и считались лишними в Периодической системе, однако благородные газы заняли свое место в ней. Из-за заполненного последнего энергетического уровня долгое время считалось, что эти вещества не могут образовывать связи, и после открытия их молекулярных соединений многие ученые были в шоке и не могли этому поверить, потому что это не поддавалось законам химии, существовавшим в то время. Неудачные попытки образования соединений благородных газов неблагоприятно сказывались на энтузиазме ученых, однако это не помешало развиваться данной отрасли. Я попытаюсь вызвать интерес у присутствующих в аудитории, перед которыми я представляю свою работу.
Цели и задачи Цель работы: изучить историю создания и свойства неорганических соединений ксенона. Задачи: 1. Ознакомиться с историей получения соединения благородных газов 2. Понять, почему образования данных соединений возможны 3. Ознакомиться со свойствами фтористых и кислородных соединений 4. Донести результаты моей работы до сверстников
История создания Все попытки получения этих соединений были безуспешными, ученые лишь могли предполагать, как будут выглядеть их формулы и примерные свойства. Самым продуктивным химиком в этой области являлся Нил Бартлетт. Его главная заслуга – получение гексафторплатината ксенона Xe [ PtF 6 ].
Фториды ксенона Фторид ксенона (II) Фторид ксенона (IV) Фторид ксенона (VI)
Оксиды ксенона Оксид ксенона (VI) Оксид ксенона (VIII) ВЗРЫВООПАСНО!!!
Применение соединений ксенона Для производства ракетного топлива Для создания лекарств и медицинского оборудования Для производства взрывчатки Как способ перевозки фтора Как окислители в органической и неорганической химии
Заключение Соединения благородных газов - одна из интереснейших тем в органической и неорганической химии, открытие свойств их соединений перевернуло с ног на голову представление всех ученых 20 века, потому что в то время существование таких веществ считалось невозможным, а сейчас это воспринимается как нечто нормальное, то, чему уже найдено объяснение.
Спасибо за внимание!
Благодаря завершенности внешнего электронного уровня благородные газы химически инертны. До 1962 г. считалось, что они вообще не образуют химических соединений. В Краткой химической энциклопедии (М., 1963, т. 2) написано: «Соединений с ионной и ковалентной связями инертные газы не дают». К этому времени были получены некоторые соединения клатратного типа, в которых атом благородного газа механически удерживается в каркасе, образованном молекулами другого вещества. Например, при сильном сжатии аргона над переохлажденной водой был выделен кристаллогидрат Аг 6Н 2 0. В то же время все попытки заставить благородные газы вступать в реакции даже с самыми энергичными окислителями (такими, как фтор) заканчивались безрезультатно. И хотя теоретики во главе с Лайнусом Полингом предсказывали, что молекулы фторидов и оксидов ксенона могут быть устойчивы, экспериментаторы говорили: «Этого не может быть».
Везде на протяжении этой книги мы стараемся подчеркивать две важных идеи:
- 1) в науке нет незыблемых истин;
- 2) в химии возможно АБСОЛЮТНО ВСЕ, даже то, что на протяжении десятков лет кажется невозможным или нелепым.
Эти идеи прекрасно подтвердил канадский химик Нил Бартлетт, когда в 1962 г. получил первое химическое соединение ксенона. Вот как это было.
В одном из экспериментов с гексафторидом платины PtF 6 Бартлетт получил красные кристаллы, которые по результатам химического анализа имели формулу 0 2 PtF 6 и состояли из ионов 0 2 и PtF 6 . Это означало, что PtF 6 - настолько сильный окислитель, что отнимает электроны даже у молекулярного кислорода! Бартлетт решил окислить еще какое-нибудь эффектное вещество и сообразил, что отнять электроны у ксенона еще легче, чем у кислорода (потенциалы ионизации 0 2 12,2 эВ и Хе 12,1 эВ). Он поместил в сосуд гексафторид платины, запустил туда точно измеренное количество ксенона и через несколько часов получил гексафтороплатинат ксенона.
Сразу вслед за этой реакцией Бартлетт осуществил реакцию ксенона с фтором. Оказалось, что при нагревании в стеклянном сосуде ксенон реагирует с фтором, при этом образуется смесь фторидов.
Фторид ксенона^ II) XeF 2 образуется под действием дневного света на смесь ксенона с фтором при обычной температуре
![]()
или при взаимодействии ксенона и F 2 0 2 при -120 °С.
Бесцветные кристаллы XeF 2 растворимы в воде. Молекула XeF 2 - линейная. Раствор XeF 2 в воде - очень сильный окислитель, особенно в кислой среде. В щелочной среде XeF 2 гидролизуется:
Фторид ксенона(Ч) XeF 4 образуется при нагревании смеси ксенона с фтором до 400 °С.
XeF 4 образует бесцветные кристаллы. Молекула XeF 4 - квадрат с атомом ксенона в центре. XeF 4 - очень сильный окислитель, используется как фторирующий агент.

При взаимодействии с водой XeF 4 диспропорционирует.
Фторид ксенона(Ч1) XeF 6 образуется из элементов при нагревании и повышенном давлении фтора.
XeF 6 - бесцветные кристаллы. Молекула XeF 6 представляет собой искаженный октаэдр с атомом ксенона в центре. Подобно другим фторидам ксенона, XeF 6 - очень сильный окислитель и может использоваться как фторирующий агент.
XeF 6 частично разлагается водой:
Оксид ксенона(У I) Хе0 3 образуется при гидролизе XeF 4 (см. выше). Это белое, нелетучее, очень взрывоопасное вещество, хорошо растворимое в воде, причем раствор имеет слабокислую реакцию из-за протекания следующих реакций:
При действии озона на щелочной раствор Хе0 3 образуется соль ксеноновой кислоты, в которой ксенон имеет степень окисления +8.
Оксид ксенона(У1Н) Хе0 4 может быть получен при взаимодействии перксената бария с безводной серной кислотой при низких температурах.
Хе0 4 - бесцветный газ, очень взрывоопасен и разлагается при температурах выше О °С.
Из соединений других благородных газов известны KrF 2 , KrF 4 , RnF 2 , RnF 4 , RnF 6 , Rn0 3 . Считается, что аналогичные соединения гелия, неона и аргона вряд ли будут когда-нибудь получены в виде индивидуальных веществ.
Выше мы утверждали, что в химии «возможно все». Сообщим поэтому, что соединения гелия, неона и аргона существуют в виде так называемых эксимерных молекул, т.е. молекул, у которых устойчивы возбужденные электронные состояния и неустойчиво основное состояние. Например, при электрическом возбуждении смеси аргона и хлора может протекать газофазная реакция с образованием эксимерной молекулы АгС1.
Аналогично при реакциях возбужденных атомов благородных газов можно получить целый набор двухатомных молекул, таких как Не 2 , HeNe, Ne 2 , NeCl, NeF, HeCl, ArF и т. д. Все эти молекулы неустойчивы и не могут быть выделены в виде индивидуальных веществ, однако их можно зарегистрировать и изучить их строение с помощью спектроскопических методов. Более того, электронные переходы в эксимерных молекулах используются для получения УФ-излучения в мощных эксимерных УФ-лазерах.
Наиболее изученными соединениями благородных газов являются фториды ксенона.
Фторид ксенона (II), или днфторид ксенона. Это соединение может быть получено прямым взаимодействием ксенона и фтора при освещении ртутной дуговой лампой. Его можно также получить взаимодействием ксенона с при температуре - 120 С:
Дифторид ксенона состоит из линейных молекул. В присутствии щелочей он гидролизуется с выделением кислорода:
Кроме дифторида ксенона известны также дифторид криптона и дифторид радона
Фторид ксенона (IV), или тетрафторид ксенони. Это соединение получают прямым взаимодействием ксенона и фтора при температуре 400 °С:

(В скобках справа показана плоская квадратная структура молекул тетрафторида ксенона.) Это соединение диспропорционирует в воде с образованием оксида и свободного ксенона:
Фторид или гексафторид ксенона. Это соединение получают прямым взаимодействием ксенона с фтором при температуре 300 °С и повышенном давлении. Оно имеет структуру искаженного октаэдра. Гексафторид ксенона реагирует с кремнеземом, образуя оксотетрафторид
Аргон, криптон и ксенон образуют также клатратные соединения, или соединения включения. Например, гидрат ксенона представляет собой каркас из молекул воды с включенными в него атомами ксенона. Молекулы воды удерживаются в этом каркасе водородными связями. Если из водного раствора гидрохинона находящегося в атмосфере ксенона, криптона или аргона под давлением, кристаллизовать гидрохинон, получаются клатратные соединения соответствующих благородных газов с гидрохиноном.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПОЛУЧЕНИЕ И ПРИМЕНЕНИЯ
Неон, аргон, криптон и ксенон существуют только в атмосферном воздухе (табл. 16.20).
Гелий встречается не только в атмосферном воздухе, но также в месторождениях природного газа. По распространенности во Вселенной этот элемент занимает второе место вслед за водородом. Радон содержится в микроскопических количествах в земной атмосфере. Этот элемент радиоактивен. Его наиболее распространенный изотоп, радон-222, имеет период полураспада 3,823 сут. Этот изотоп образуется при
Таблица 16.20. Содержание благородных газов в земной атмосфере

Распаде радия:
По имеющимся оценкам, каждая квадратная миля (приблизительно 2,5 кв. км) почвы на Земле, в слое глубиной шесть дюймов (около 15 см), содержит приблизительно 1 г радия.
Благородные газы получают из жидкого воздуха путем фракционной перегонки с последующей абсорбцией активированным углем.
Применения
Плотность гелия вдвое больше, чем у водорода. Однако он намного безопаснее водорода и поэтому используется для наполнения аэростатов и метеорологических зондов; кроме того, он применяется в космической технике.
Смесь из 80% гелия и 20% кислорода используется в качестве искусственной атмосферы для дыхания водолазов. Преимуществом такой атмосферы является то, что гелий обладает гораздо меньшей растворимостью в крови, чем азот, и поэтому применение искусственной атмосферы позволяет избавить водолазов от «кессонной болезни» (вскипания крови из-за выделения растворенного в ней азота при быстром подъеме с больших глубин). Гелий и аргон служат для создания инертной атмосферы при сварке. Кроме того, гелий применяется для создания защитной атмосферы при выращивании сверхчистых кристаллов германия и кремния.
Аргоном наполняют электролампы и различные типы флюоресцентных трубок и фотоумножителей.
Связи с завершенностью внешнего электронного уровня благородные газы чрезвычайно химически инертны. До 1962 г. считалось, что они вообще не образуют химических соединений. К этому времени были получены некоторые соединения клатрат-ного типа, в которых атом благородного газа механически (без образования химических связей) удерживается в каркасе, образованном молекулами другого вещества. Например, при сильном сжатии аргона над переохлажденной водой был выделен кристаллогидрат Аг 6Н20. В то же время все попытки заставить благородные газы вступать в реакции даже с самыми энергичными окислителями (такими, как фтор) заканчивались безрезультатно. Первое химическое соединение, в котором атом благородного газа образует химические связи с другими элементами, получил в 1962 г. Н. Бартлетт. В одном из экспериментов с гексафторидом платаны PtF* Бартлетт получил красные кристаллы, которые по результатам химического анализа имели формулу 02PtF6 и состояли из ионов С>2* и PtF6~. Это означало, что PtFfi - настолько сильный окислитель, что отнимает электроны даже у кислорода. Бартлетт решил окислить еще какое-нибудь эффектное вещество и сообразил, что отнять электроны у ксенона еще легче, чем у кислорода (потенциалы ионизации: 12,2 эВ у О* и 12,1 эВ у Хе). Он поместил в сосуд гексафторид платины, запустил туда точно измеренное количество ксенона и через несколько часов получил гексафтороплатинат ксенона: Вскоре Бартлетт осуществил и реакцию ксенона с фтором. Оказалось, что ксенон хорошо реагирует с фгором при нагревании в стеклянном сосуде, при этом образуется смесь фторидов. Фторид ксенона (II) XeF2 образуется под действием дневного света на смесь ксенона с фтором при обычной температуре: или при взаимодействии ксенона и F202 при -120 °С: XeF2 - бесцветные кристаллы, растворимые в воде. Молекула XeF2 линейна. Раствор XeF2 в воде - очень сильный окислитель, особенно в кислой среде, где он способен окислять бром и марганец до их высшей степени окисления (+7). В щелочной среде XeF2 гидролизуется по уравнению: Фторид ксенона (IV) XeF4 образуется при нагревании смеси ксенона с фтором до 40Q °С: XeF* представляет собой бесцветные кристаллы. Молекула XeF4 - «квадрат» с атомом ксенона в центре. XeF4 - очень сильный окислитель, используется как фторирующий агент: При взаимодействии с водой XeF4 диспропорционирует: Фторид ксенона (VI) XeF6 образуется из элементов при нагревании и повышенном давлении фтора: XeFe - бесцветные кристаллы. Молекула XeF« представляет собой искаженный октаэдр с атомом ксенона в центре. Подобно другим фторидам ксенона, XeF6 - очень сильный окислитель, может использоваться как фторирующий агент: Водой XeF6 частично разлагается: Оксид ксенона (VI) Хе03 образуется при гидролизе XeF4 (см. выше). Это - белое, нелетучее, очень взрывчатое вещество, хорошо растворимо в воде, причем раствор имеет слабокислую среду за счет реакции: При действии озона на щелочной раствор ХЮ3 образуется соль ксеноновой кислоты, в которой ксенон имеет степень окисления 4-8: Оксид ксенона (VIII) Хе04 может быть получен при взаимодействии перкссната бария с безводной серной кислотой при низких температурах: Хе04 - бесцветный газ, который очень взрывоопасен и разлагается при температурах выше О °С: Из соединений других благородных газов известны KrF2, KtF4, RnF2, RnF4, RnF6, Rn03. Считается, что аналогичные соединения гелия, неона и аргона вряд ли будут когда-нибудь получены в виде индивидуальных веществ. Тем не менее химические соединения гелия, неона и аргона существуют в виде так называемых эксимерных молекул, т. е. молекул, у которых устойчивы возбужденные электронные состояния и неустойчиво основное состояние. Например, при электрическом возбуждении смеси аргона и хлора возможна газофазная реакция с образованием зксимерной молекулы ArCL Аналогично, при реакциях возбужденных атомов благородных газов можно получить целый набор двухатомных молекул, таких, как Нег, Ne2, NeF и т. д. Все эти молекулы неустойчивы и не могут быть выделены в виде индивидуальных веществ, однако их можно зарегистрировать и изучить строение их молекул с помощью спектроскопических методов.