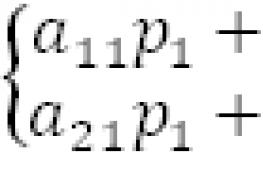Подготовка к впр. Подготовка к впр Дана схема окислительно-восстановительной реакции
Всероссийская проверочная работа
Химия, 11 класс
Пояснения к образцу всероссийской проверочной работы
При ознакомлении с образцом проверочной работы следует иметь в виду, что задания, включенные в образец, не отражают всех умений и вопросов содержания, которые будут проверяться в рамках всероссийской проверочной работы. Полный перечень элементов содержания и умений, которые могут проверяться в работе, приведен в кодификаторе элементов содержания и требований к уровню подготовки выпускников для разработки всероссийской проверочной работы по химии. Назначение образца проверочной работы заключается в том, чтобы дать представление о структуре всероссийской проверочной работы, количестве и форме заданий, об уровне их сложности.
Образец всероссийской проверочной работы по истории
Инструкция по выполнению работы
Проверочная работа включает в себя 15 заданий. На выполнение работы по истории отводится 1 час 30 минут (90 минут).
Записывайте ответы на задания в отведенном для этого месте в работе. В случае записи неверного ответа зачеркните его и напишите рядом новый.
При выполнении работы разрешается использовать следующие дополнительные материалы:
Периодическая система химических элементов Д. И. Менделеева;
Таблица растворимости солей, кислот и оснований в воде;
Электрохимический ряд напряжений металлов;
Непрограммируемый калькулятор.
При выполнении заданий Вы можете использовать черновик. Записи в черновике проверяться и оцениваться не будут.
Советуем выполнить задания в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удается выполнить сразу, и переходите к следующему. Если после выполнения всей работы у Вас останется время, Вы сможете вернуться к пропущенным заданиям.
Баллы, полученные за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество балов.
1. Из курса химии Вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация. На рисунках 1-3 представлены примеры использования некоторых из перечисленных способов.
Какие из названных способов разделения смесей можно применить для очищения:
1. Стальных кнопок от древесных опилок;
2. Воздуха от распыленных в помещении мелких капель водоэмульсионной краски?
Запишите в таблицу номер рисунка и название соответствующего способа разделения смеси.
Ответ:
2. На рисунке изображена схема распределения электронов по энергетическим уровням атома некоторого химического элемента.

На основании предложенной схемы выполните следующие задания:
1. Определите химический элемент, атом которого имеет такое электронное строение;
2. Укажите номер периода и номер группы в Периодической системе химических элементов Д. И. Менделеева, в которых расположен этот элемент;
3. Определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
Ответы запишите в таблицу.
Ответ:
3. Периодическая система химических элементов Д. И. Менделеева - богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Так, например, известно, что с увеличением порядкового номера химического элемента в периодах радиусы атомов уменьшаются, а в группах увеличиваются.
Учитывая эти закономерности, расположите в порядке уменьшения радиуса атомов следующие элементы: N, Al, C, Si. Запишите обозначения элементов в нужной последовательности.
Ответ: Al - Si - C - N.
4. В приведенной ниже таблице перечислены характерные свойства веществ с молекулярной и атомной кристаллическими решетками.
Характерные свойства веществ
Используя данную информацию, определите, какую кристаллическую решетку имеет:
1. Кварц (SiO2);
2. Углекислый газ (СО2).
Запишите ответ:
Кварц имеет ________________
Углекислый газ имеет _________________
Ответ: кварц (SiO2) имеет атомную кристаллическую решетку; углекислый газ (СО2) имеет молекулярную кристаллическую решетку.
Прочитайте текст и выполните задания 5-7.
Оксид серы (IV) используют в пищевой промышленности в качестве консерванта (пищвая добавка Е220). Поскольку этот газ убивает микроорганизмы, им окуривают овощехранилища и склады. Это вещество также используют для отбеливания соломы, шёлка и шерсти, то есть материалов, которые нельзя отбеливать хлором.
Промышленный способ получения этого вещества заключается в сжигании серы или сульфидов. В лабораторных условиях его получают воздействием сильных кислот на сульфиты, например, взаимодействием серной кислоты с сульфитом натрия.
При взаимодействии оксида серы (IV) с гидроксидом кальция образуется соль сульфит кальция. Это вещество применяется в промышленности как пищевая добавка Е226, консервант, для приготовления желе, мармелада, мороженого, напитков и фруктовых соков.
5. Сложные неорганические вещества условно можно распределить, то есть классифицировать, по четырем группам, как показано на схеме. В эту схему для каждой из четырех групп впишите по одной химической формуле веществ, упоминаемых в приведенном выше тексте.
Сложные вещества:
оксид -
основание -
кислота -
соль -
Ответ: оксид - SO2
основание - Ca(OH)2
кислота - H2SO4
соль - Na2SO3 или CaSO3.
6. 1. Составьте молекулярное уравнение реакции сжигания серы, о которой говорилось в тексте.
Ответ: S + O2 = SO2
2. Укажите, с каким тепловым эффектом (с поглощением или выделением теплоты) протекает эта реакция.
Ответ: реакция протекает с выделением энергии (экзотермическая).
7. 1. Составьте молекулярное уравнение упомянутой в тексте реакции между оксидом серы (IV) и гидроксидом кальция.
Ответ: Ca(OH)2 + SO2 = CaSO3 + H2O
2. Опишите признаки протекающей реакции между оксидом серы (IV) и раствором гидроксида кальция.
Ответ: в результате реакции образуется нерастворимое вещество - сульфит кальция; наблюдается помутнение исходного раствора (выпадение осадка).
8. При исследовании минерализации бутиллированной воды в ней были обнаружены следующие катионы металлов: Ag2+, Na+, Mg2+. Для проведения качественного анализа к этой воде добавили раствор CaCl2.
1. Какие изменения можно наблюдать в растворе при проведении данного опыта (концентрация вещества достаточная для проведения анализа)?
Ответ: наблюдается выпадение белого творожистого осадка.
2. Запишите сокращенное ионное уравнение произошедшей химической реакции.
Ответ: Ag+ + Cl- = AgCl↓
9. Дана схема окислительно-восстановительной реакции.
HNO3 + Cu = Cu(NO3)2 + NO2 + H2O
1. Составьте электронный баланс этой реакции.
Ответ: составлен электронный баланс.
2| N+5 +e → N+ 4
1| Cu0 -2e → Cu+2
2. Укажите окислитель и восстановитель.
Ответ: указано, что медь в степени окисления 0 является восстановителем, а HNO3 (или азот в степени окисления +5) - окислителем.
3. Расставьте коэффициенты в уравнении реакции.
Ответ: составлено уравнение реакции: 4HNO3 + Cu = Cu(NO3)2 + 2NO2 + 2H2O
10. Дана схема превращений:
Na2S → H2S → SO2 → BaSO3
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
Ответ:
1. Na2S + 2HCl = 2NaCl + H2S
2. 2H2S + 3O2 = 2SO2 + 2H2O
3.SO2 + Ba(OH)2 = BaSO3 + H2O
(Допускаются иные, не противоречащие условию задания уравнения реакций.)
Для выполнения заданий 11-13 используйте вещества, приведенные в перечне:
1. Этан
2. Ацетилен
3. Толуол
4. Метанол
5. Ацетальдегид
11. Из приведенного перечня выберите вещества, которые соответствуют указанным классам/группам органических соединений. Запишите номера структурных формул этих веществ в соответствии с названиями.
Предельный углеводород -
Одноатомный спирт -
Ответ:
Предельный углеводород - этан С2Н6
Одноатомный спирт - метанол СН3ОН.
12. В предложенные схемы химических реакций впишите структурные формулы пропущенных веществ, выбрав их из приведенного выше перечня. Расставьте коэффициенты в полученные схемы, чтобы получилось уравнение химической реакции.
1. ....... + Cl2 = CH3CH2Cl + HCl
2. ........ + Cu(OH)2 = CH3COOH + Cu2O + H2O
Ответ: 
13. Толуол является сырьем для производства компонентов моторных топлив с высоким октановым числом, для получения взрывчатых веществ (тринитротолуола), фармацевтических препаратов, красителей и растворителей. Получить толуол можно в соответствии с приведенной ниже схемой превращений.
Впишите в заданную схему превращений структурную формулу вещества Х, выбрав его из предложенного выше перечня.

Запишите уравнения двух реакций, с помощью которых можно осуществить эти превращения. При записи уравнений реакций используйте структурные формулы веществ.
Ответ: 
14. Одним из важных понятий в экологии и химии является "предельно допустимая концентрация" (ПДК). ПДК - это такое содержание вредного вещества в окружающей среде, присутствуя в которой постоянно данное вещество не оказывает в течение всей жизни прямого или косвенного неблагоприятного влияния на настоящее или будущее поколение, не снижает работоспособности человека, не ухудшает его самочувствия и условий жизни.
ПДК формальдегида в воздухе составляет 0.003 мг/м3. В помещении площадью 40 кв. м с высотой потолка 2,5 м с поверхности дверей, изготовленных из древесно-стружечных плит (ДСП), пропитанных фенолформальдегидной смолой, испарилось 1,2 мг формальдегида. Определите, превышена ли ПДК формальдегида в воздухе данного помещения. Предложите способ, позволяющий снизить концентрацию формальдегида в помещении.
Ответ: 1. Определен объем помещения, и определена концентрация формальдегида в нем:
V (помещения) = 40 х 2,5 = 100 куб. м
2. Сформулирован вывод о превышении ПДК; значение ПДК формальдегида в помещении превышает показатель 0,003 мг/ куб. м;
3. Сформулировано одно предложение по снижению содержания формальдегида в помещении.
Возможные варианты: замена дверей на новые, сделанные из другого материала (например, древесины); покрытие поверхности дверей пленкой, слоем лака или краски; регулярное проветривание (вентиляция) помещений.
15. Для обработки обожжённых кожных покровов применяют 5%-ный раствор перманганата калия. Рассчитайте массы перманганата калия и воды, котоые необходимы для приготовления 120 г такого раствора. Запишите подробное решение задачи.
Ответ: m(KMnO4) = 0,05 x 120 = 6 г
m(воды) = 120-6 = 114 г
Решение.
Осно́вные свойства оксидов химических элементов ослабевают слева направо по периоду. Поэтому последовательность в порядке ослабления осно́вных свойств оксидов элементов следующая: магний - алюминий - фосфор.
Ответ: - -
Ответ: Mg&Al&P
Источник: ВПР 2019 г. Химия. 11 класс. Вариант 5.
· Прототип задания ·
2019 год объявлен Международным годом Периодической таблицы химических элементов Д. И. Менделеева. Мировое научное сообщество отметит 150-летие открытия Периодического закона химических элементов Д. И. Менделеевым в 1869 году. Периодическая система химических элементов Д. И. Менделеева - богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений. Так, например, известно, что с увеличением порядкового номера химического элемента кислотные свойства высших гидроксидов (кислот) в периодах усиливаются, а в группах ослабевают. Учитывая эти закономерности, расположите в порядке усиления кислотных свойств их высших гидроксидов следующие элементы: углерод, бор, азот. В ответе запишите символы элементов в нужной последовательности.
Решение.
Кислотные свойства высших гидроксидов химических элементов усиливаются слева направо в периоде. Поэтому последовательность в порядке усиления кислотных свойств их высших гидроксидов химических элементов следующая: бор - углерод - азот.
Ответ: - -
Ответ: B&C&N
Источник: ВПР 2019 г. Химия. 11 класс. Вариант 6.
· Прототип задания ·
2019 год объявлен Международным годом Периодической таблицы химических элементов Д. И. Менделеева. Мировое научное сообщество отметит 150-летие открытия Периодического закона химических элементов Д. И. Менделеевым в 1869 году. Периодическая система химических элементов Д. И. Менделеева - богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений. Так, например, известно, что с увеличением порядкового номера химического элемента осно́вный характер гидроксидов в периодах ослабевает, а в группах усиливается. Учитывая эти закономерности, расположите в порядке усиления осно́вных свойств их гидроксидов следующие элементы: кальций, стронций, магний. В ответе запишите символы элементов в нужной последовательности.
Решение.
Осно́вный характер гидроксидов химических элементов усиливается сверху вниз по группе. Поэтому последовательность в порядке усиления осно́вных свойств их гидроксидов элементов следующая: магний - кальций - стронций.
Ответ: - -
Ответ: Mg&Ca&Sr
Источник: ВПР 2019 г. Химия. 11 класс. Вариант 7.
· Прототип задания ·
2019 год объявлен Международным годом Периодической таблицы химических элементов Д. И. Менделеева. Мировое научное сообщество отметит 150-летие открытия Периодического закона химических элементов Д. И. Менделеевым в 1869 году. Периодическая система химических элементов Д. И. Менделеева - богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений. Так, например, известно, что с увеличением порядкового номера химического элемента осно́вные свойства оксидов в периодах ослабевают, а в группах усиливаются. Учитывая эти закономерности, расположите в порядке ослабления осно́вных свойств их оксидов следующие элементы: алюминий, фосфор, магний. В ответе запишите символы элементов в нужной последовательности.
Решение.
Осно́вные свойства оксидов химических элементов ослабляются слева направо в периоде. Поэтому последовательность в порядке ослабления осно́вных свойств оксидов элементов следующая: азот - кислород - фтор.
Ответ: - -
Ответ: N&O&F
Источник: ВПР 2019 г. Химия. 11 класс. Вариант 9.
· Прототип задания ·
2019 год объявлен Международным годом Периодической таблицы химических элементов Д. И. Менделеева. Мировое научное сообщество отметит 150-летие открытия Периодического закона химических элементов Д. И. Менделеевым в 1869 году. Периодическая система химических элементов Д. И. Менделеева - богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений. Так, например, известно, что с увеличением порядкового номера химического элемента кислотный характер высших оксидов в периодах усиливается, а в группах ослабевает. Учитывая эти закономерности, расположите в порядке ослабления кислотных свойств их высших оксидов следующие элементы: алюминий, фосфор, сера. В ответе запишите символы элементов в нужной последовательности.
Решение.
Кислотный характер высших оксидов химических элементов ослабляется справа налево в периоде. Поэтому последовательность в порядке ослабления кислотных свойств высших оксидов элементов следующая: сера - фосфор - алюминий.
Ответ: - -
Ответ: S&P&Al
Источник: ВПР 2019 г. Химия. 11 класс. Вариант 11.
2019 год объявлен Международным годом Периодической таблицы химических элементов Д. И. Менделеева. Мировое научное сообщество отметит 150-летие открытия Периодического закона химических элементов Д. И. Менделеевым в 1869 году. Периодическая система химических элементов Д. И. Менделеева - богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений. Так, например, известно, что с увеличением порядкового номера химического элемента основные свойства оксидов в периодах ослабевают, а в группах усиливаются. Учитывая эти закономерности, расположите в порядке усиления основных свойств их оксидов следующие элементы: алюминий, магний, натрий. В ответе запишите символы элементов в нужной последовательности.
Решение.
Основные свойства оксидов химических элементов усиливаются в периоде справа налево. Поэтому последовательность в порядке усиления основных свойств оксидов элементов следующая: алюминий - магний - натрий.
Ответ: - -
Ответ: Al&Mg&Na
Источник: ВПР 2019 г. Химия. 11 класс. Вариант 12.
· Прототип задания ·
2019 год объявлен Международным годом Периодической таблицы химических элементов Д. И. Менделеева. Мировое научное сообщество отметит 150-летие открытия Периодического закона химических элементов Д. И. Менделеевым в 1869 году. Периодическая система химических элементов Д.И. Менделеева - богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений. Так, например, известно, что с увеличением порядкового номера химического элемента кислотные свойства высших гидроксидов (кислот) в периодах усиливаются, а в группах ослабевают. Учитывая эти закономерности, расположите в порядке ослабления кислотных свойств их высших гидроксидов следующие элементы: углерод, бериллий, азот. В ответе запишите символы элементов в нужной последовательности.
Решение.
Кислотные свойства высших гидроксидов химических элементов ослабляются справа налево в периоде. Поэтому последовательность в порядке ослабления кислотных свойств высших гидроксидов элементов следующая: азот - углерод - бериллий.
Ответ: - -
Ответ: N&C&Be
Источник: ВПР 2019 г. Химия. 11 класс. Вариант 13.
· Прототип задания ·
2019 год объявлен Международным годом Периодической таблицы химических элементов Д. И. Менделеева. Мировое научное сообщество отметит 150-летие открытия Периодического закона химических элементов Д. И. Менделеевым в 1869 году. Периодическая система химических элементов Д.И. Менделеева - богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений. Так, например, известно, что с увеличением порядкового номера химического элемента способность атомов принимать электроны - окислительные свойства - в периодах усиливается, а в группах ослабевает. Учитывая эти закономерности, расположите в порядке усиления их окислительных свойств следующие элементы: азот, фтор, углерод. В ответе запишите символы элементов в нужной последовательности.
Решение.
Окислительные свойства химических элементов усиливаются в периоде слева направа. Поэтому последовательность в порядке усиления окислительных свойств элементов следующая: углерод - азот - фтор.
Ответ: - -
Ответ: C&N&F
Источник: ВПР 2019 г. Химия. 11 класс. Вариант 15.
2019 год объявлен Международным годом Периодической таблицы химических элементов Д. И. Менделеева. Мировое научное сообщество отметит 150-летие открытия Периодического закона химических элементов Д. И. Менделеевым в 1869 году. Периодическая система химических элементов Д. И. Менделеева - богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений. Так, например, известно, что с увеличением порядкового номера химического элемента способность отдавать электроны - восстановительная способность - в периодах ослабевает, а в группах усиливается. Учитывая эти закономерности, расположите в порядке усиления восстановительной способности следующие элементы: рубидий, натрий, калий. В ответе запишите символы элементов в нужной последовательности.
Решение.
Восстановительная способность химических элементов увеличивается сверху вниз по в подгруппе. Поэтому последовательность в порядке усиления восстановительной способности элементов следующая: натрий - калий - рубидий.
Ответ: - -
Ответ: Na&K&Rb
Источник: ВПР 2019 г. Химия. 11 класс. Вариант 16.
· Прототип задания ·
2019 год объявлен Международным годом Периодической таблицы химических элементов Д. И. Менделеева. Мировое научное сообщество отметит 150-летие открытия Периодического закона химических элементов Д. И. Менделеевым в 1869 году. Периодическая система химических элементов Д.И. Менделеева - богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений. Так, например, известно, что с увеличением порядкового номера химического элемента кислотный характер высших оксидов в периодах усиливается, а в группах ослабевает. Учитывая эти закономерности, расположите в порядке усиления кислотных свойств их высших оксидов следующие элементы: алюминий, сера кремний. В ответе запишите символы элементов в нужной последовательности.
Решение.
Кислотный характер высших оксидов химических элементов усиливается слева направо в периоде. Поэтому последовательность в порядке кислотных свойств высших оксидов элементов следующая: алюминий - кремний - сера.
Ответ: - -
Ответ: Al&Si&S
Источник: ВПР 2019 г. Химия. 11 класс. Вариант 18.
· Прототип задания ·
2019 год объявлен Международным годом Периодической таблицы химических элементов Д. И. Менделеева. Мировое научное сообщество отметит 150-летие открытия Периодического закона химических элементов Д. И. Менделеевым в 1869 году. Периодическая система химических элементов Д.И. Менделеева - богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений. Так, например, известно, что с увеличением порядкового номера химического элемента основные свойства оксидов в периодах ослабевают, а в группах усиливаются. Учитывая эти закономерности, расположите в порядке ослабления основных свойств их оксидов следующие элементы: калий, натрий, кальций. В ответе запишите символы элементов в нужной последовательности.
Решение.
Основные свойства оксидов химических элементов ослабляются в снизу вверх в подгруппе. Поэтому последовательность в порядке ослабления основных свойств оксидов элементов следующая: калий - натрий - кальций.
Ответ: - -
Ответ: K&Na&Ca
Источник: ВПР 2019 г. Химия. 11 класс. Вариант 19.
· Прототип задания ·
Периодическая система химических элементов Д. И. Менделеева - богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Так, например, известно, что с увеличением порядкового номера химического элемента в периодах электроотрицательность атомов увеличивается, а в группах - уменьшается.
Приложение 3. Периодическая система химических элементов Д.И. Менделеева
Задания 3.
1. Задание 3 №
Периодическая система химических элементов Д. И. Менделеева - богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Так, например, известно, что с увеличением порядкового номера химического элемента в периодах радиусы атомов уменьшаются, а в группах увеличиваются.
Учитывая эти закономерности, расположите в порядке увеличения радиусов атомов следующие элементы: N, C, Al, Si
2. Задание 3 №
C, Ca, B, Al
В ответе укажите обозначения элементов разделяя &. Например, 11&22.
3 . Задание 3 №
Известно, что с увеличением порядкового номера элемента в периодах металлические свойства атомов уменьшаются, а в группах увеличиваются. Расположите в порядке увеличения металлических свойств, следующие элементы: N, Na, Mg, K. Запишите обозначения элементов в нужной последовательности.
В ответе укажите обозначения элементов разделяя &. Например, 11&22.
4 . Задание 3 №
Периодическая система химических элементов Д. И. Менделеева - богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Так, например, известно, что с увеличением порядкового номера химического элемента в периодах радиусы атомов уменьшаются, а в группах - увеличиваются.
Учитывая эти закономерности, расположите в порядке уменьшения радиуса атомов следующие элементы: O, P, S, Cl. Запишите обозначения элементов в нужной последовательности.
В ответе укажите обозначения элементов разделяя &. Например, 11&22.
5 . Задание 3 №
Периодическая система химических элементов Д. И. Менделеева - богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Так, например, известно, что с увеличением порядкового номера химического элемента в периодах электроотрицательность атомов увеличивается, а в группах - уменьшается.
Учитывая эти закономерности, расположите в порядке увеличения электроотрицательности следующие элементы: C, N, Si, Ge. Запишите обозначения элементов в нужной последовательности.
В ответе укажите обозначения элементов разделяя &. Например, 11&22.
6 . Задание 3 №
Периодическая система химических элементов Д. И. Менделеева - богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Например, известно, что с увеличением порядкового номера химического элемента в периодах электроотрицательность атомов увеличивается, а в группах - уменьшается.
Учитывая эти закономерности, расположите в порядке уменьшения электроотрицательности следующие элементы: B, C, N, Al. Запишите обозначения элементов в нужной последовательности.
В ответе укажите обозначения элементов разделяя &. Например, 11&22.
7 . Задание 3 №
Учитывая эти закономерности, расположите в порядке усиления кислотных свойств высших оксидов следующие элементы: B, C, N, Al. Запишите обозначения элементов в нужной последовательности.
В ответе укажите обозначения элементов разделяя &. Например, 11&22.
8 . Задание 3 №
Периодическая система химических элементов Д. И. Менделеева - богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Так, например, известно, что кислотный характер высших оксидов элементов в периодах с увеличением заряда ядра усиливается, а в группах - уменьшается.
Учитывая эти закономерности, расположите в порядке ослабления кислотных свойств высших оксидов следующие элементы: P, As, S, Cl. Запишите обозначения элементов в нужной последовательности.
В ответе укажите обозначения элементов разделяя &. Например, 11&22.
9 . Задание 3 №
Периодическая система химических элементов Д. И. Менделеева - богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Например, известно, что кислотный характер бескислородных кислот с увеличением заряда ядра атома усиливается и в периодах, и в группах.
Учитывая эти закономерности, расположите в порядке усиления кислотных свойств водородные соединения: 1) H 2 O 2) HF 3) H 2 S 4) HCl
В ответе укажите номера химических формул в нужной последовательности.
10 . Задание 3 №
Периодическая система химических элементов Д. И. Менделеева - богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, от способах получения веществ, а также о нахождении их в природе. Так, например, известно, что лёгкость отдачи электронов атомами элементов в периодах с увеличением заряда ядра уменьшается, а в группах - возрастает.
Учитывая эти закономерности, расположите в порядке увеличения легкости отдачи электронов следующие элементы: B, C, N, Al.
В ответе укажите обозначения элементов разделяя &. Например, 11&22.
11 . Задание 3 №
Периодическая система химических элементов Д.И. Менделеева – богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Так, например, известно, что с увеличением порядкового номера химического элемента в периодах радиусы атомов уменьшаются, а в группах увеличиваются.
Учитывая эти закономерности, расположите в порядке уменьшения радиуса атомов следующие элементы: N, Al, C, Si. Запишите обозначения элементов в нужной последовательности.
В ответе укажите обозначения элементов разделяя &. Например, 11&22.
12 . Задание 3 №
Периодическая система химических элементов Д.И. Менделеева – богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений. Так, например, известно, что с увеличением порядкового номера химического элемента оснóвный характер оксида в периодах уменьшается, а в группах возрастает.
Учитывая эти закономерности, расположите в порядке усиления основности оксидов следующие элементы: Na, Al, Mg, B. Запишите символы элементов в нужной последовательности.
13 . Задание 3 №
Периодическая система химических элементов Д.И. Менделеева – богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений. Так, например, известно, что с увеличением порядкового номера химического элемента оснóвный характер оксида в периодах уменьшается, а в группах возрастает. Учитывая эти закономерности, расположите в порядке усиления основности оксидов следующие элементы: Mg, Al, K, Ca. Запишите символы элементов в нужной последовательности.
ВПР Всероссийская Проверочная Работа- Химия 11 класс
Пояснения к образцу всероссийской проверочной работы
При ознакомлении с образцом проверочной работы следует иметь в виду, что задания, включённые в образец, не отражают всех умений и вопросов содержания, которые будут проверяться в рамках всероссийской проверочной работы. Полный перечень элементов содержания и умений, которые могут проверяться в работе, приведены в кодификаторе элементов содержания и требований к уровню подготовки выпускников для разработки всероссийской проверочной работы по химии. Назначение образца проверочной работы заключается в том, чтобы дать представление о структуре всероссийской проверочной работы, количестве и форме заданий, уровне их сложности.
Инструкция по выполнению работы
Проверочная работа включает в себя 15 заданий. На выполнение работы по химии отводится 1 час 30 минут (90 минут).
Оформляйте ответы в тексте работы согласно инструкциям к заданиям. В случае записи неверного ответа зачеркните его и запишите рядом новый.
При выполнении работы разрешается использовать следующие дополнительные материалы:
– Периодическая система химических элементов Д.И. Менделеева;
– таблица растворимости солей, кислот и оснований в воде;
– электрохимический ряд напряжений металлов;
– непрограммируемый калькулятор.
При выполнении заданий Вы можете использовать черновик. Записи в черновике проверяться и оцениваться не будут.
Советуем выполнять задания в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удаётся выполнить сразу, и переходите к следующему. Если после выполнения всей работы у Вас останется время, Вы сможете вернуться к пропущенным заданиям.
Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Желаем успеха!
1. Из курса химии Вам известны следующие способы разделения смесей : отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация. На рисунках 1–3 представлены примеры использования некоторых из перечисленных способов.
Какие из названных способов разделения смесей можно применить для очищения:
1) муки от попавших в неё железных опилок;
2) воды от растворённых в ней неорганических солей?
Запишите в таблицу номер рисунка и название соответствующего способа разделения смеси.
железные опилки притягиваются магнитом
при перегонке после конденсации паров воды в сосуде остаются кристаллы соли
2. На рисунке изображена модель электронного строения атома некоторого химического элемента.

На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, атом которого имеет такое электронное строение;
2) укажите номер периода и номер группы в Периодической системе химических элементов Д.И. Менделеева, в которых расположен этот элемент;
3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
Ответы запишите в таблицу.
Ответ:
N; 2; 5 (или V); неметалл
для определения химического элемента следует посчитать общее количество электронов,которое мы видим на рисунке (7)
взяв таблицу Менделеева, мы с легкостью можем определить элемент (найденное кол-во электронов равняется атомному номеру элемента) (N- азот)
после этого определяем номер группы (вертикальный столбец) (5) и природу данного элемента (неметалл)
3. Периодическая система химических элементов Д.И. Менделеева
– богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Так, например, известно, что с увеличением порядкового номера химического элемента в периодах радиусы атомов уменьшаются, а в группах увеличиваются.
Учитывая эти закономерности, расположите в порядке увеличения радиусов атомов следующие элементы: N, C, Al, Si. Запишите обозначения элементов в нужной последовательности.
Ответ: ____________________________
N → C → Si → Al
4. В приведённой ниже таблице перечислены характерные свойства веществ, которые имеют молекулярное и ионное строение.
Используя данную информацию, определите, какое строение имеют вещества азот N2 и поваренная соль NaCl. Запишите ответ в отведённом месте:
1) азот N2 ________________________________________________________________
2) поваренная соль NaCl ___________________________________________________
азот N2 – молекулярное строение;
поваренная соль NaCl – ионное строение
5. Сложные неорганические вещества условно можно распределять, то есть классифицировать, по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите пропущенные названия групп или химические формулы веществ (по одному примеру формул), принадлежащих к данной группе.

Записаны названия групп: основания, соли;
записаны формулы веществ соответствующих групп
CaO, основания, HCl, соли
Прочитайте следующий текст и выполните задания 6–8.
В пищевой промышленности используется пищевая добавка Е526, которая представляет собой гидроксид кальция Ca(OH)2. Она находит применение при производстве: фруктовых соков, детского питания, маринованных огурцов, пищевой соли, кондитерских изделий и сладостей.
Получение гидроксида кальция в промышленном масштабе возможно путём смешивания оксида кальция с водой
, этот процесс называется гашение.
Широкое применение гидроксид кальция получил в производстве таких строительных материалов, как белила, штукатурка и гипсовые растворы. Это связано с его способностью взаимодействовать с углекислым газом CO2
, содержащимся в воздухе. Это же свойство раствора гидроксида кальция применяется для измерения количественного содержания углекислого газа в воздухе.
Полезным свойством гидроксида кальция является его способность выступать в роли флокулянта, очищающего сточные воды от взвешенных и коллоидных частиц (в том числе солей железа). Он также используется для повышения рН воды, так как природная вода содержит вещества (например, кислоты
), вызывающие коррозию в сантехнических трубах.
1. Составьте молекулярное уравнение реакции получения гидроксида кальция, которая
упоминалась в тексте.
2. Объясните, почему этот процесс называют гашением.
Ответ:__________________________________________________________________________
________________________________________________________________________________
1) CaO + H 2 O = Ca(OH) 2
2) При взаимодействии оксида кальция с водой выделяется большое
количество теплоты, поэтому вода закипает и шипит, как при попадании на раскалённый уголь, когда костёр гасят водой (или «гашением данный процесс назван, потому что в результате образуется гашёная известь»)
1. Составьте молекулярное уравнение реакции между гидроксидом кальция и углекислым
газом, которая упоминалась в тексте.
Ответ:__________________________________________________________________________
2. Объясните, какие особенности этой реакции позволяют использовать её для обнаружения
углекислого газа в воздухе.
Ответ:__________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) Ca(OH) 2 + CO 2 = CaCO 3 ↓ + H 2 O
2) В результате этой реакции образуется нерастворимое вещество – карбонат кальция, наблюдается помутнение исходного раствора, что и позволяет судить о наличии углекислого газа в воздухе (качественная
реакция на CO 2)
1. Составьте сокращённое ионное уравнение упомянутой в тексте реакции между
гидроксидом кальция и соляной кислотой.
Ответ:__________________________________________________________________________
2. Объясните, почему эту реакцию используют для повышения рН воды.
Ответ:__________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) OH – + H + = H 2 O (Ca(OH)2+ 2HCl = CaCl2 + 2H2O)
2) Наличие кислоты в природной воде обусловливает низкие значения pH этой воды. Гидроксид кальция нейтрализует кислоту, и значения pH повышаются
шкала pH существует от 0-14. от 0-6 — кислая среда, 7- нейтральная среда, 8-14 — щелочная среда
9. Дана схема окислительно-восстановительной реакции.
H 2 S + Fe 2 O 3 → FeS + S + H 2 O
1. Составьте электронный баланс этой реакции.
Ответ:__________________________________________________________________________
2. Укажите окислитель и восстановитель.
Ответ:__________________________________________________________________________
3. Расставьте коэффициенты в уравнении реакции.
Ответ:__________________________________________________________________________
1) Составлен электронный баланс:
| 2Fe +3 + 2ē → 2Fe +2 | 2 | 1 | |
| 2 | |||
| S -2 – 2ē → S 0 | 2 | 1 |
2) Указано, что сера в степени окисления –2 (или H 2 S) является восстановителем, а железо в степени окисления +3 (или Fe 2 O 3) – окислителем;
3) Составлено уравнение реакции:
3H 2 S + Fe 2 O 3 = 2FeS + S + 3H 2 O
10. Дана схема превращений:
Fe → FeCl 2 → Fe(NO 3) 2 → Fe(OH) 2
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить
указанные превращения.
1) _________________________________________________________________________
2) _________________________________________________________________________
3) _________________________________________________________________________
Написаны уравнения реакций, соответствующие схеме превращений:
1) Fe + 2HCl = FeCl 2 + H 2
2) FeCl 2 + 2AgNO 3 = Fe(NO 3) 2 + 2AgCl
3) Fe(NO 3) 2 + 2KOH = Fe(OH) 2 + 2KNO 3
(Допускаются иные, не противоречащие условию задания уравнения
реакций.)
11. Установите соответствие между формулой органического вещества и классом/группой , к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ:
| А | Б | В |
- C3H8 — CnH2n+2 — алкан
- C3H6 — CnH2n- алкен
- C2H6O — CnH2n+2O- спирт
12. В предложенные схемы химических реакций вставьте формулы пропущенных веществ и расставьте коэффициенты.
1) С 2 Н 6 + ……………..… → С 2 Н 5 Cl + HCl
2) C 3 H 6 + ……………..… → CO 2 + H 2 O
1) С 2 Н 6 + Cl 2 → С 2 Н 5 Cl + HCl
2) 2C 3 H 6 + 9O 2 → 6CO 2 + 6H 2 O
(Возможны дробные коэффициенты.)
13. Пропан сгорает с низким уровнем выброса токсичных веществ в атмосферу
, поэтому его используют в качестве источника энергии во многих областях, например в газовых зажигалках и при отоплении загородных домов.
Какой объём углекислого газа (н.у.) образуется при полном сгорании 4,4 г пропана?
Запишите подробное решение задачи.
Ответ:__________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) Составлено уравнение реакции горения пропана:
С 3 Н 8 + 5О 2 → 3СО 2 + 4Н 2 О
2) n(С 3 Н 8) = 4,4/44 = 0,1 моль
n(СО 2) = 3n(С 3 Н 8) = 0,3 моль
3) V(О 2) = 0,3 · 22,4 = 6,72 л
14. Изопропиловый спирт используют как универсальный растворитель: он входит в состав средств бытовой химии, парфюмерной и косметической продукции, стеклоомывающих жидкостей для автомобилей. В соответствии с приведённой ниже схемой составьте уравнения реакций получения этого спирта. При написании уравнений реакций используйте структурные формулы органических веществ.

1) _______________________________________________________
2) _______________________________________________________
3) _______________________________________________________
Написаны уравнения реакций, соответствующие схеме:

(Допускаются иные, не противоречащие условию задания уравнения реакций.)
15. Физиологическим раствором в медицине называют 0,9%-ный раствор хлорида натрия в воде.
Рассчитайте массу хлорида натрия и массу воды, которые необходимы для приготовления 500 г физиологического раствора. Запишите подробное решение задачи.
Ответ:__________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) m(NaCl) = 4,5 г
2) m(воды) = 495,5 г
m(р-ра) = 500г m(соли) = x
x/500 * 100%= 0,9%
m(cоли) = 500* (0,9/100)= 4,5 г
© 2017 Федеральная служба по надзору в сфере образования и науки Российской Федерации